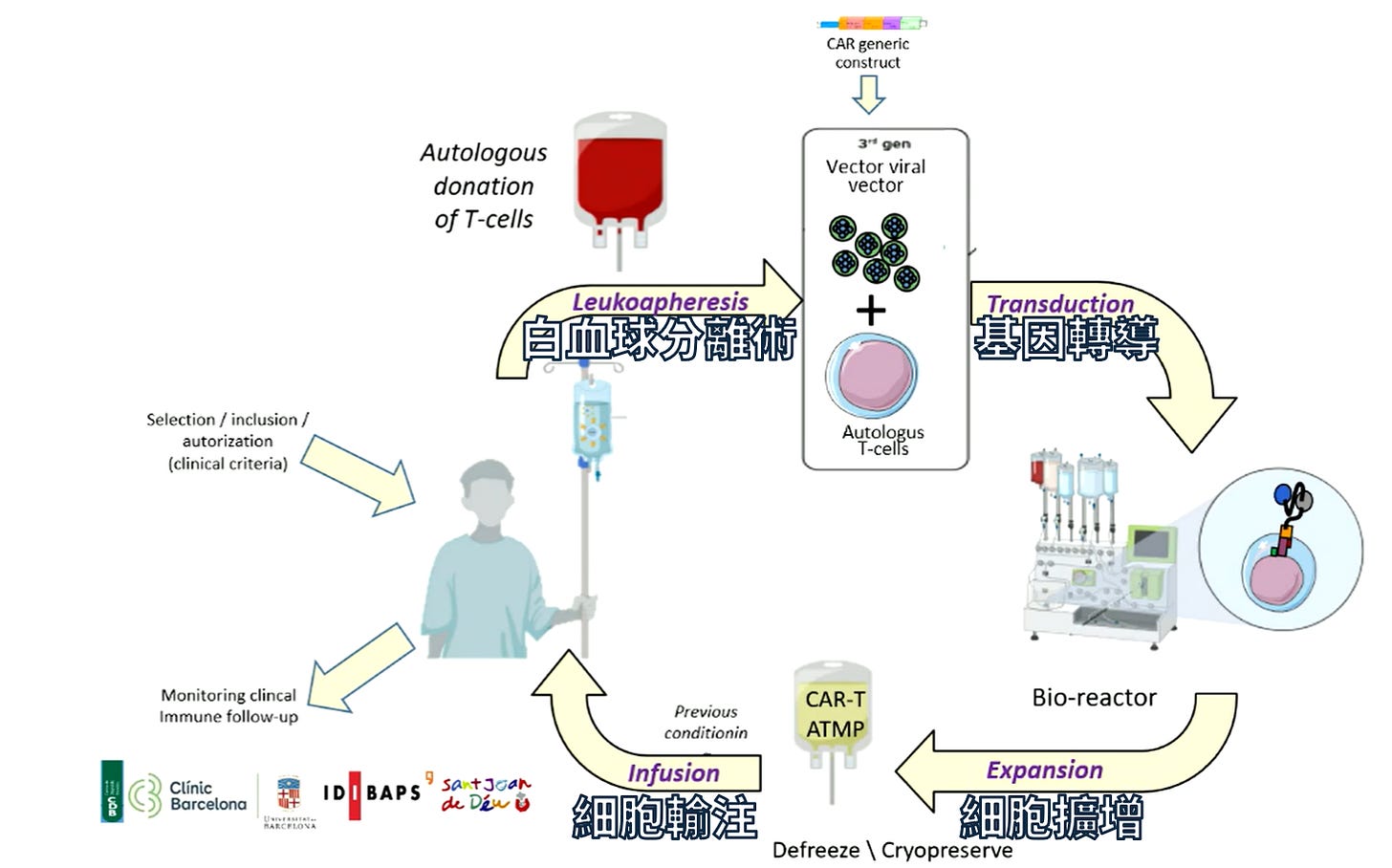
細胞治療各階段說明 (1):白血球分離術 (Leukapheresis)
細胞治療,尤其是 CAR-T 大概可分為四階段:白血球分離術 (Leukapheresis) → 基因轉導 (Transduction) → 細胞擴增 (Expansion) → 細胞輸注 (Infusion)
文 | Gem Huai-Chueh Wu 吳懷珏
細胞來源
在所有核准的 CAR-T 細胞產品中,T 細胞均取自患者本身(自體),但也有可能從接受者的幹細胞供體(異體)異體幹細胞移植 (HSCT) 後獲得 T 細胞,這仍是實驗性的。
以異體 CAR-T 而言,幹細胞植入應發生在白血球去除術之前。而異體 CAR-T 而言,理論上存在移植物抗宿主疾病 (GVHD) 或免疫原性的風險,且 CAR-T 細胞會被受體的免疫系統迅速消除。
雖然現行 CAR-T 細胞主要來自周邊血,臍帶血 (UCB) 衍生的 T 或自然殺手 (NK) 細胞也可以是一種選擇,儘管 UCB 僅被授權用於幹細胞移植。 UCB 的免疫學和表型特徵可降低 UCB 移植後移植物抗宿主疾病 (GVHD) 的發生率。值得注意的是,與週邊 T 細胞相比,來自 UCB 的 T 細胞表達的耗竭標記物更低,從而具有更好的長期持久性和效率。
術前篩檢
患者合併症和病史:ECOG PS、血小板計數和腎功能不全與分離術術中不良事件 (adverse event, AE) 相關 (Ann Oncol. 2022)。
找出淋巴細胞收集效率(定義:每產品體積的淋巴細胞計數 / 每次處理的週邊血體積的平均淋巴細胞計數)低落的風險族群:高齡、ALL、白血球分離術前的血小板量較多容易卡住孔洞 (Tuazon, et. al., Transfusion, 2019)、已經歷多線治療的病人 (Heavily pre-treated),這些人可能有大量惡性細胞在血液循環中,或是淋巴球偏少。而收集到較高的 T 細胞數量可能與緩解的機率有正相關。
收集前確認病人血球比容 (hematocrit, Hct) 維持在 40% 以上。
橋接治療 (bridging therapy,或稱過渡治療)
各不相同,包括化療、標靶治療、自體造血幹細胞移植 (auto-HSCT)、局部放射治療以及局部冷凍消融 (localized cryoablation)。以 B-ALL 為例,會使用 inotuzumab 和 blinatumomab 等組合來減少惡性 B 細胞。
高腫瘤負擔 (high tumor burden) 與 CAR-T 不良預後息息相關,如果橋接治療無法好好地減少腫瘤,效果可以想見地不佳,CRS 比例更高。
BTKi 在一些疾病如 Mantle cell lymphoma (MCL) 上可能對 CAR-T 有不錯的效果,試驗進行中,參考 Boardman, (2024). Blood. 未來還可能加入 IL-17 等 cytokines。
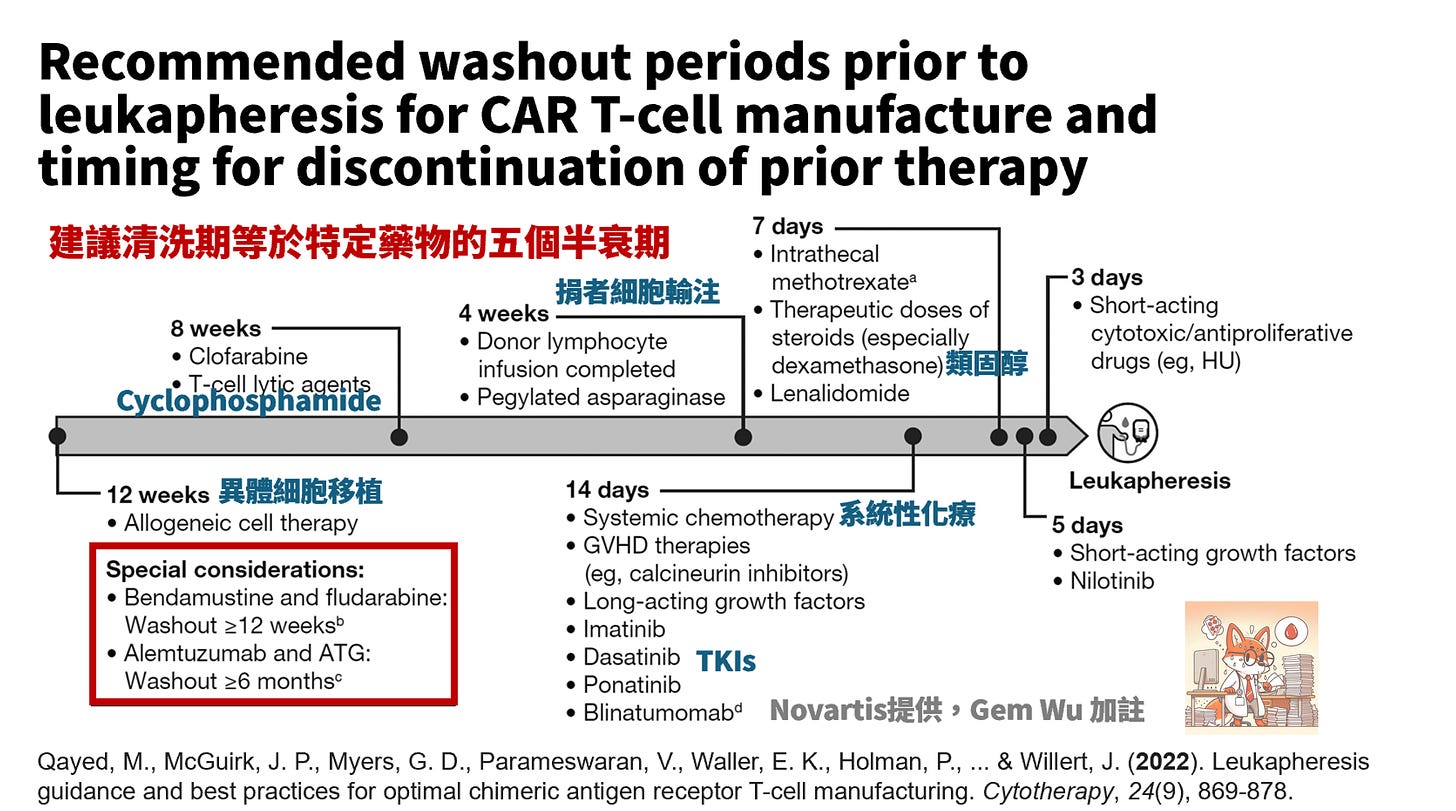
術前清除藥物 (washout of medications)
建議清洗期等於特定藥物/藥物的五個半衰期
直接影響 T 細胞或 CD19 表現的藥物可能需要超過五個半衰期。
分離術時機
盡早收集 T 細胞,或在 CAR-T 輸注後使用 ICI 可能會增強 CAR-T 細胞的功效,這是目前正在研究的策略。
挽救治療 (salvage therapy) 的選擇可能會對隨後的白血球去除術嘗試產生不利影響,因為它與 T 細胞計數恢復和品質有關。
需要 CAR-T 來治療異體移植 (allo-HSCT) 後復發的情況則不太可能在移植前就收好血球,比較建議收集新鮮的血品 (Siglin, Blood. 2020; Bartolo-Ibars, Cancers. 2021)
冷凍保存的最佳時間是採集後儘快,但最多在採集後 24 小時內 (Cytotherapy. 2019)
術時病人端配置與臨床面向
可在門診執行。
管路:週邊管路考量包括靜脈位置、完整性、彈性、大小以及靜脈是否能夠支持平均採集的血流速度 (85 mL/min);兒科病人則大多數需要中心靜脈導管來啟動和維持血流 (Semin Oncol Nurs. 2021)。
輸血:使用白血球去除過濾器和 PRBC 照射 (irradiated LPR)。
抗凝血劑:首選抗凝血劑檸檬酸葡萄糖溶液A (ACD-A)。為了降低低血鈣的風險,結合調整流速,可以在ACD-A中添加肝素以降低檸檬酸鹽濃度。
分離術時副作用處置
透過在分離術前對患者進行徹底的評估可以預防許多不良事件。
電解質方面:應監測離子鈣和鎂。最常見的AE 包括手足抽搐等檸檬酸鹽反應(低血鈣)、術後疲勞、暈厥、短暫意識喪失、低血壓、噁心、嘔吐和出汗。
血管循環方面:血管迷走神經/低血容反應、空氣栓塞、體外溶血、血腫、心律不整。
過敏反應。
分離術時檢驗與收集量
用於輸注CAR-T細胞,通常劑量為 1–1.5 × 10^6 /kg 或 CD34 + HPC ≥ 2 × 10^6 細胞/kg 病人體重。
在白血球分離術之前或當天以多參數流式細胞儀 (multiparameter flow cytometry, MPFC) 進行監測,以標準化時間和待分析樣品的體積。
週邊血液 ALC 和 CD3+ 細胞計數是在白血球去除術產品中獲得足夠 CD3+ 細胞計數的最佳指標。一些中心將ALC 閾值設定在100/μL 至500/μL 之間,Tisa-cel 則建議 500/μL 以上,CD3+ T 細胞的最低閾值設定為150/μL,可參考堪薩斯醫學中心規格表。
日本研究指出白血球分離術時的CD3 + 細胞數,可以預測輸注後CAR-T 細胞的擴增 (T cell expansion) 以及CAR-T 細胞治療的結果 (Wada, Scientific Reports, 2022)
低收集效率病人需處理足夠量的血液,才能提高 T 細胞收集量。可允許超過一天的時間進行白血球分離術。也可使用收集演算法來預測收集量(公式見 [1] )。(Blood. 2020)
分離後的物流與保存
物流:白血球分離站點必須有效地標記材料以進行處理,並與快遞員溝通,以確保與具有溫度控制機制的最佳低溫托運人進行適當的處理程序。
保存
Tisa-cel 資料顯示當天收集並冷凍保存的白血球分離細胞,比隔天才冰的有更好的解凍後性能。隔夜細胞恢復力可能會降低 20%。
Tisa-cel 的白血球分離產品被批准在生產前冷凍保存長達 30 個月,不過在過往的資料,有些幹細胞可保存15年、臍帶血可到20年,因此被批准的時限還可能被延長。
想多瞭解冷凍分離技術的話,請參考此篇 Tyagarajan, S., Schmitt, D., Acker, C., & Rutjens, E. (2019). Autologous cryopreserved leukapheresis cellular material for chimeric antigen receptor–T cell manufacture. Cytotherapy, 21(12), 1198-1205.
過量白血球分離產物:對患者來說,可捐贈多餘的細胞以進行研究或儲存多餘的細胞以供將來使用,不過儲存的話,長期儲存費用可能是一個問題。
分離後選用細胞
全血透過密度梯度離心分離週邊血單核細胞 (PBMC) ,再經過洗滌程序以去除紅血球。
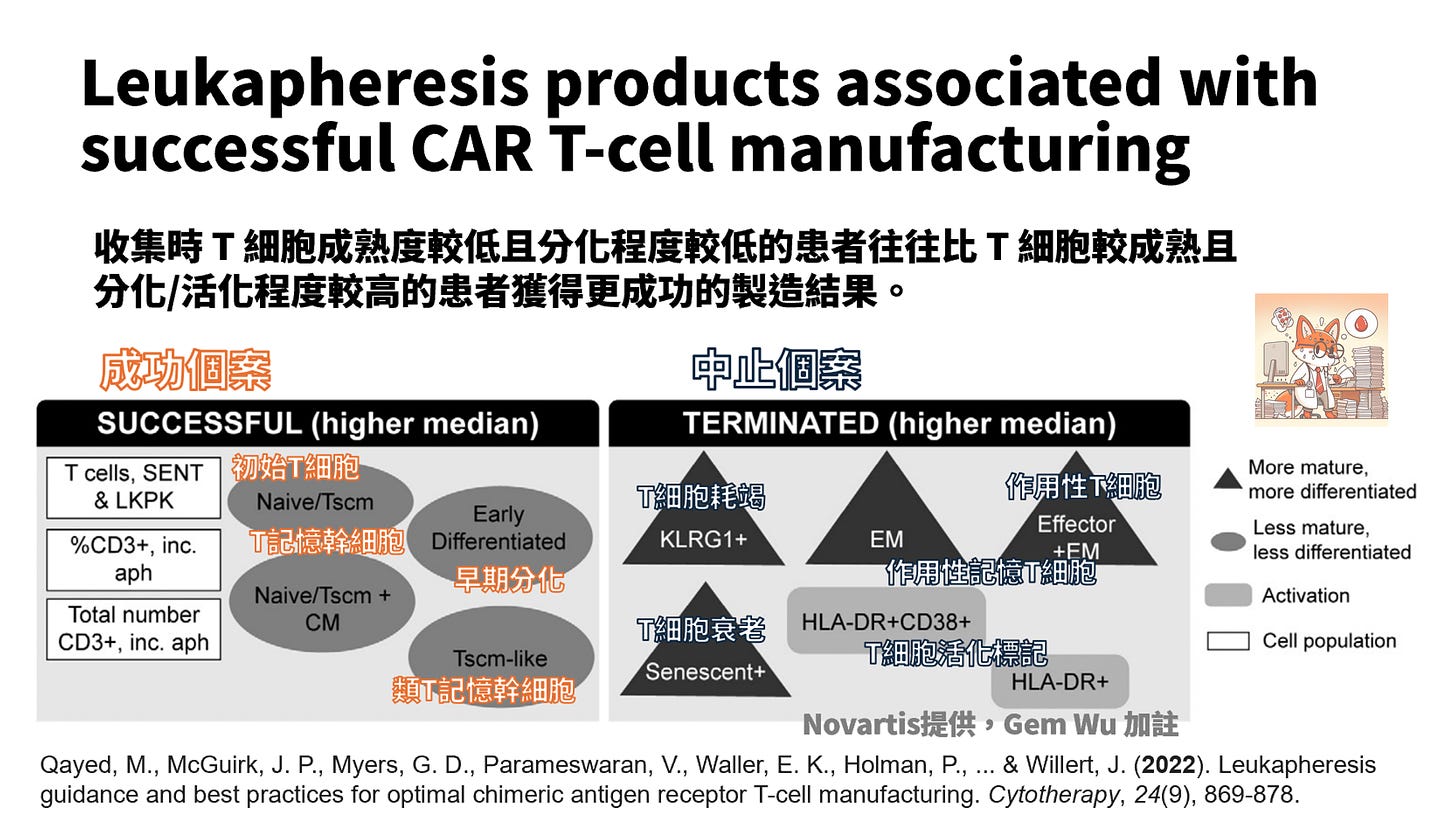
收集 T 細胞成熟度較低且分化程度較低比 T 細胞較成熟且分化/活化程度較高的患者獲得更成功的結果
白血球分離術收集透過密度梯度分離血液成分,因此該過程會產生多種細胞,而不是純 CD3+ T 細胞產品,不要的細胞包括
(1) 單核細胞,會變成巨噬細胞,並可能吞噬和消化細胞成分,包括用於CAR T 細胞上辛辛苦苦製造的 antibody-conjugated beads。
(2) 循環腫瘤細胞 (circulating tumor cells, CTC):ALL、CML、NHL 的 CTC 會導致 B 細胞和有毒惡性細胞數量升高,干擾健康 T 細胞的數量和增殖
未來在白血球去除術前評估週邊血液中 T 細胞表型並確定化療對 T 細胞的免疫調節作用的研究將有利於進一步優化 CAR T 細胞治療的白血球分離術。在 2024 Taiwan HSCT & Cell Therapy Congress 中瞭解到,台灣從 2018 至今才執行了 55 例 CAR-T,而日本每年有 500 例,至今台灣才要快步追趕。我認為我們需要更深入地了解細胞治療的細節,至少從紮實的文獻閱讀開始,才能在盡可能減少浪費的狀況下,為病人謀求更好的預後。
[1] Qayed, M., McGuirk, J. P., Myers, G. D., Parameswaran, V., Waller, E. K., Holman, P., ... & Willert, J. (2022). Leukapheresis guidance and best practices for optimal chimeric antigen receptor T-cell manufacturing. Cytotherapy, 24(9), 869-878.
[2] Pessach, I., & Nagler, A. (2023). Leukapheresis for CAR-T cell production and therapy. Transfusion and Apheresis Science, 103828.